Investigadores salmantinos describen cómo interaccionan dos proteínas que contribuyen a la resistencia mecánica de la piel
Los resultados ayudan a entender cómo se forman estas estructuras de adhesión de los epitelios
Un equipo de investigadores del Centro de Investigación del Cáncer, del Centro Universitario de la Defensa de Zaragoza y del Netherlands Cancer Institute de Ámsterdam, ha descrito como interaccionan dos proteínas esenciales para mantener la unión entre epidermis y dermis. El trabajo, publicado en la revista Structure, revela a nivel atómico cómo se produce la unión entre la integrina α6β4 y BP230, dos proteínas de los hemidesmosomas.
Los epitelios, como la epidermis, se asientan sobre unas láminas fibrosas, denominadas membranas basales, formadas por proteínas de matriz extracelular. La unión entre epitelios y membranas basales se produce a través de unos complejos multi-proteína localizados en la membrana de las células epiteliales, denominados hemidesmosomas.
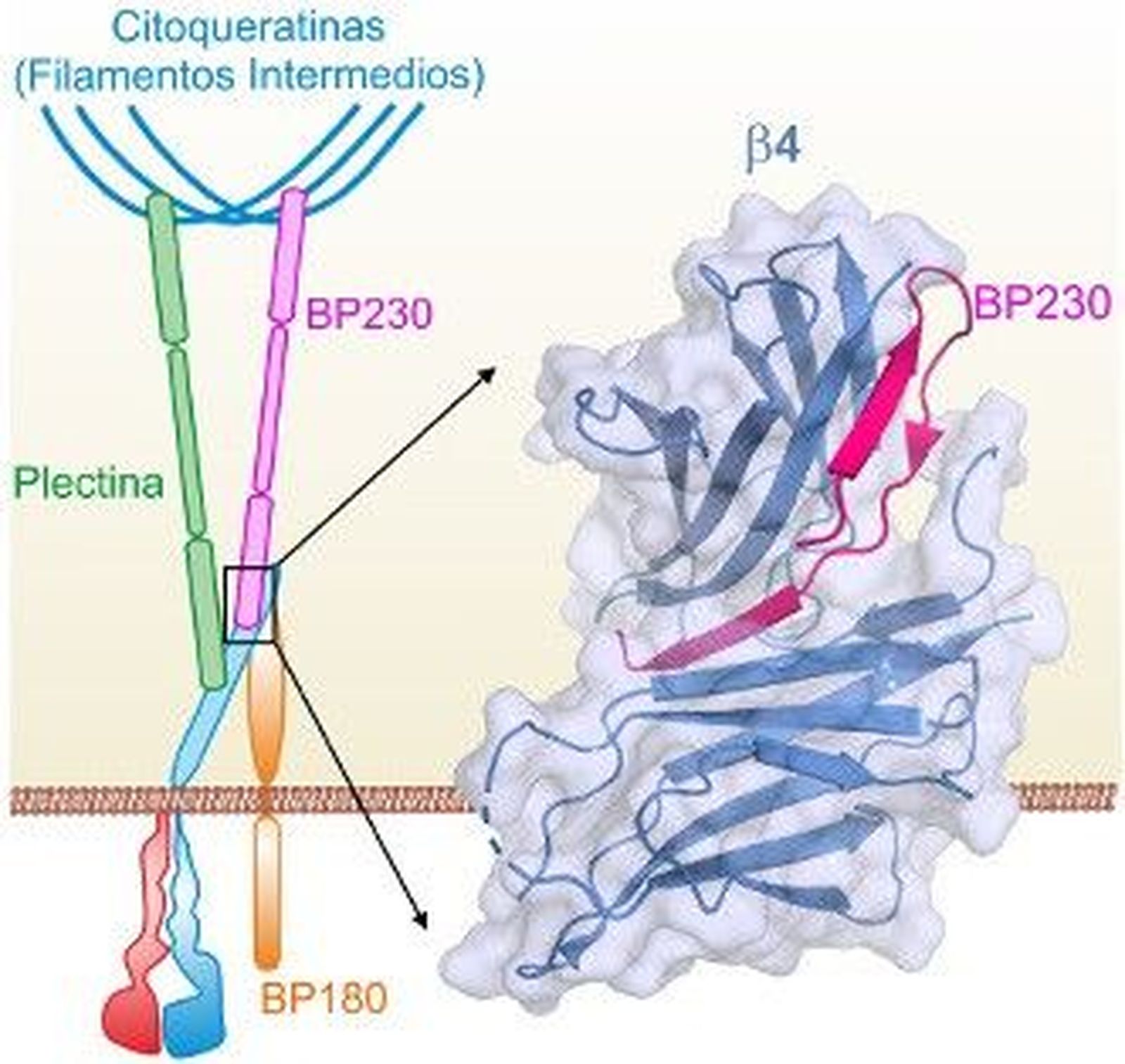
La integrina α6β4 es una proteína esencial de hemidesmosomas, que se adhiere a proteínas de la membrana basal. En el citoplasma, las proteínas plectina y BP230 se unen a α6β4 y la conectan con los filamentos intermedios del citoesqueleto. Alteraciones genéticas o autoinmunes que afectan a proteínas de los hemidesmosomas reducen la resistencia de la piel y causan enfermedades como el penfigoide ampolloso y diversos tipos de epidermolísis bullosa.
“A pesar de la relevancia de los hemidesmosomas para la integridad de la piel y otros epitelios, aún se conoce muy poco sobre la estructura y organización de estos complejos. Tampoco está del todo claro cómo se forman y desensamblan estas estructuras”, explica José María de Pereda, investigador del CSIC en el Instituto de Biología Molecular y Celular del Cáncer, que es el investigador principal del trabajo.
Con el fin de comprender cómo se organizan los hemidesmosomas, los investigadores han analizado la interacción entre las proteínas α6β4 y BP230. Primero han identificado las regiones de α6β4 y BP230 entre las que se produce el contacto. Seguidamente han empleado cristalografía de rayos-X para resolver la estructura de β4 unida a BP230.
“Con anterioridad habíamos caracterizado la interacción entre α6β4 y plectina. Ahora hemos visto que BP230 se une a α6β4 de una forma totalmente diferente. El gran nivel de detalle obtenido ha permitido identificar aminoácidos en α6β4 y BP230 que juegan un papel clave para que ambas proteínas encajen”, explica Pereda.
El trabajo también ha revelado que la unión de BP230 a α6β4 es necesaria para la incorporación de BP230 en los hemidesmosomas. Por otro lado los resultados sugieren mecanismos que podrían romper esta unión cuando los hemidesmosomas se disocian, como por ejemplo durante la cicatrización de heridas.
También te puede interesar
Lo último